お知らせ
新薬ってどうやってできるの?~誕生から販売までの長く険しい道のり~
COVID-19の世界的流行を受け、世界中の製薬会社と医薬品研究者によって治療薬やワクチンの開発が進められました。そして約一年というスピードでコロナワクチンは承認され、今も高い有効性を維持しています。開発から承認がこれほどまでに早く進んだ理由には、2002-2003年に流行した重症急性呼吸器症候群(SARS)や2012年頃から地域的に流行する中東呼吸器症候群(MERS)の原因であるスパイクタンパク質がCOVID-19にとてもよく似ていたこと、mRNAワクチンに関する長年の研究によりワクチンを設計できる技術があったことなど、いくつかの要因が重なり可能となりました。
しかし本来、新薬が誕生するまでには10年以上の時間と、多額の開発費がかかるといわれています。
今回は医薬品が誕生するまでのプロセスをお話ししていきます。
新薬開発までの3つのステージ
新薬の開発には通常下記の3つのステージに分けられます。
第一ステージ
新薬の候補物質を見つけ出し、可能性を精査する「基礎研究」
第二ステージ
動物やヒトの細胞を用いた実験を通し、医薬品の有効性や安全性を研究する「非臨床試験」
第三ステージ
選抜された医薬品をヒトへ投与し、医薬品の体内での働きや作用、副作用などを研究する「臨床治験(治験)」
開発した医薬品は国の承認審査を経て販売が可能になり、この間に要する時間は最初のステージから9~16年、販売に至る確率は22,000分の1ともいわれています。
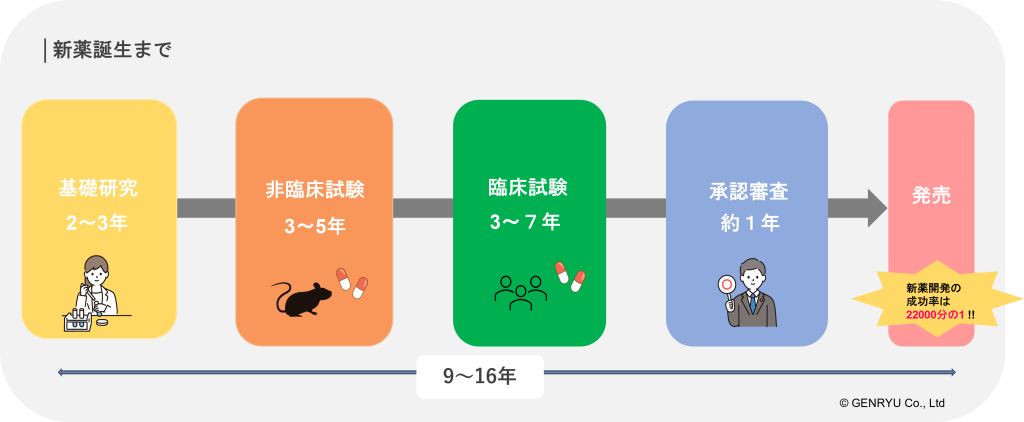
第一ステージ「基礎研究」~候補物質の発見、製造~
新薬の開発は、医薬品としての効果を持つ可能性のある新しい物質や成分の発見や、化学合成の研究からスタートします。植物や動物、鉱山など薬効のある天然物質から発見をしたり、近年では疾患に特有の物質の動きを調べ、その働きを阻害または促進させる物質を化学的に合成する手法が開発されたりしています。
ベースとなる成分が見つかると、その成分を分析し、どのような効果を持つ物質か確認する研究を行います。その際に、候補物質の有効性や安全性をより高め、より効果的なものとするために、物質の構造を化学的に変える研究も行われます。
効果が見込める成分を抽出した後もふるいにかけ、新薬のターゲットとなる物質を絞り込んでいきます。
第二ステージ「非臨床試験」~新規物質の有効性と安全性の研究~
医薬品には、目的とする治療や改善の作用とともに、さまざまな副次的な作用が生じます。その副作用を確認するため、ヒトに医薬品を投与する前に動物やヒト由来の細胞を用いて試験を行います。
非臨床試験は、「薬理学的試験」「薬物動態試験」「毒性試験」と呼ばれる試験を中心に実施します。非臨床試験についてのルールと承認申請時に必要なデータは国の基準(GLP省令)にまとめられています。
薬理学的試験
ヒトの体組織などを用いて効力を裏付ける試験や、投与量に応じた変化を調べる試験管内試験を行う。
薬物動態試験
動物の体内で医薬品の有効成分がどのように吸収され目的の部位に届けられるか、生体内での物質の合成や分解などの化学反応、体外への排出の動きなどを調べる。
毒性試験
ヒトの体組織や動物を用いて、短期的または長期的な影響、発がん性、胎児への影響などを調べる。
第三ステージ「臨床試験」~新薬開発の最終段階~
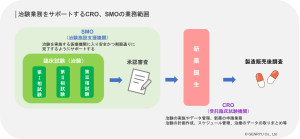
新薬の開発の最終段階となるのが臨床試験(治験)です。効果の安全性と有効性の慎重な検証のため、3段階の試験が設定されています。治験は新薬開発の中でも特に時間とコストがかかることと、適正に運用されなければならないため外部機関であるCRO(受託臨床試験期間)やSMO(治験実施支援機関)へ委託されることが一般的です。
第Ⅰ相試験
少数の健康な人へ、医薬品の有効成分がヒトの生体内で実際にどのように働き、排出されるか、副作用や安全性などを確認する。
第Ⅱ相試験
対象とする疾患患者へ、有効性と安全性のバランスがとれた投与量を探る試験を実施する。
第Ⅲ相試験
多くの疾患患者へ、プラセボと呼ばれる偽薬群と医薬品投与群の比較や、既存の治療法との比較を通して新薬が本当に意義のあるものか検討する。
承認審査
医薬品の製造販売には、企業は厚生労働省に承認申請を行い、認められなければいけません。これまでの非臨床試験と臨床試験で収集・分析したさまざまなデータをもとに、厚生労働省と連携している行政法人医薬品医療機器総合機構(PMDA)が有効性や安全性などの審査実務を行います。PMDAの審査報告を受け、薬事・食品衛生審議会で議論され、審査を通過すると製造販売承認が得られます。審査までの期間は一般的に1年とされていますが、それ以上に時間がかかる場合もあります。
また実際に医療機関で使用された結果、開発段階で発見されなかった副作用や、適正な使用情報などが、製薬企業の医薬情報担当者(MR)によって情報収集されます。
MRについてはこちら
まとめ
いかがでしたでしょうか。このように、10年以上といわれる長期のプロセスを経て医薬品が販売されます。新薬一剤の誕生がいかに長く険しい道のりかご理解いただけたのではないでしょうか。
日本はアメリカ、スイスに並び世界3位の医薬品創出国です。日本の優れた新薬開発力は、日本国内だけではなく世界にも高い貢献度を誇っており、今日も世界中の患者さんに届けられています。
最後に
私たち、株式会社GENRYUは医学情報に係る著作権の専門家です。
事業やサービスの存在意義を徹底して掘り下げることで新たな価値を最大限に引き出します。
著作物の転載許諾の代行、文献手配、学術情報の代行検索、文書管理システム開発支援、
Webプラットフォーム開発などの多岐にわたる事業でお客様のプロジェクトを成功に導きます。
また、企画から制作、設計開発、導入支援、その後の運用保守まで全ての工程を
ワンストップでお受けいたします。
↓ お問い合わせはこちら ↓
お電話や、メールでもご相談を受け付けております。
☎:050-5530-3700
✉:mail@genryu.net

